
ISOƒRƒ“ƒTƒ‹ƒ^ƒ“ƒgپFHOMEپ@>پ@ISOƒRƒ“ƒTƒ‹ƒeƒBƒ“ƒOƒTپ[ƒrƒXپ@>پ@ISO13485ƒRƒ“ƒTƒ‹ƒeƒBƒ“ƒO

ISOƒRƒ“ƒTƒ‹ƒ^ƒ“ƒgپFHOMEپ@>پ@ISOƒRƒ“ƒTƒ‹ƒeƒBƒ“ƒOƒTپ[ƒrƒXپ@>پ@ISO13485ƒRƒ“ƒTƒ‹ƒeƒBƒ“ƒO
ISO13485‚ئ‚حˆم—أ‹@ٹي‚ج•iژ؟•غڈط‚ج‚½‚ك‚جچ‘چغ•Wڈ€‹Kٹi‚إ‚·پB
ˆم—أ‹@ٹيƒپپ[ƒJپ[‹y‚رٹضکAƒTپ[ƒrƒX‚ً’ٌ‹ں‚µ‚ؤ‚¢‚é‘gگD‚ة“K—p‚³‚ê‚é•iژ؟ƒ}ƒlƒWƒپƒ“ƒgƒVƒXƒeƒ€‚جچ\’z‚ًˆسگ}‚µ‚½‹Kٹi‚إ‚·پB
ˆم—أ‹@ٹي‚ًˆµ‚¤‹ئژيŒü‚ج“ء•ت—v‹پژ–چ€‚ئ‚µ‚ؤپA1996”N‚ةISO13485/13488‚ھ’aگ¶پi1998”N‚ة‰ü’ùپj‚µ‚ـ‚µ‚½پB
‰ü’ù‚³‚ꂽISO13485پF2003‚حISO9001پF2000‚ًƒxپ[ƒX‚ةچىگ¬‚³‚ê‚ـ‚µ‚½‚ھپAڈ]—ˆ‚ج”إ‚ئ‚حˆظ‚ب‚èپAISO9001‚ئ‚ح“ئ—§‚µ‚½ƒVƒXƒeƒ€—v‹پژ–چ€‚ئ‚µ‚ؤˆت’u•t‚¯‚ç‚ê‚ؤ‚¨‚èپAŒع‹q—v‹پژ–چ€‹y‚ر‹Kگ§—v‹پژ–چ€‚ًˆêٹر‚µ‚ؤ–‚½‚·ˆم—أ‹@ٹي‚ً’ٌ‹ں‚·‚é”\—ح‚ً‚à‚آ‚±‚ئ‚ًژہڈط‚·‚邽‚ك‚ةژg‚ي‚ê‚ـ‚·پB
Œ»چفپAˆم—أ‹@ٹي‚ج•iژ؟پAˆہ‘S‚جٹîڈ€‚ًچ‘چغ“I‚ة•Wڈ€‰»‚·‚邽‚كپAٹeچ‘‚ئ‚à–@‹Kگ§‚ج‹Kٹi‚ئ‚µ‚ؤISO13485‚ًچج—p‚·‚é•ûŒü‚ة‚ ‚è‚ـ‚·پB
گl‘ج‚ة‰e‹؟‚ً—^‚¦‚é‹@ٹي‚ًژو‚舵‚¤ˆبڈمپA‚»‚ج•iژ؟‹y‚رˆہ‘Sگ«‚ة‚حپAچ×گS‚ج”z—¶‚ھ•¥‚ي‚ê‚é•K—v‚ھ‚ ‚邽‚كپA‘gگD‚ئ‚µ‚ؤگ»•i/ƒTپ[ƒrƒX‚جƒٹƒXƒN‚ً‚¢‚©‚ةٹا—‚µ‚ؤ‚¢‚‚©‚ةڈإ“_‚ھچi‚ç‚ê‚ؤ‚¢‚ـ‚·پB
ISO13485‚ة‚حپAˆم—أ‹@ٹي‚ة“ء—L‚ج—v‹پژ–چ€‚ھ‘½‚گ·‚èچ‚ـ‚ê‚ؤ‚¢‚ـ‚·پB
ISO9001‚ة‚حٹـ‚ـ‚ê‚ؤ‚¢‚ب‚¢پAˆم—أ‹@ٹي‚ة•K—v‚ب•iژ؟پAˆہ‘S‚ةٹض‚·‚é—v‹پژ–چ€‚ھژه‚ب‚à‚ج‚ة‚ب‚ء‚ؤ‚¢‚ـ‚·پB
ˆê•ûپAISO9001‚إ—v‹پ‚³‚ê‚ؤ‚¢‚éپAپuŒع‹q–‘«پvپuŒp‘±“I‰ü‘Pپv‚ةٹض‚·‚é—v‹پ‚حٹـ‚ـ‚ê‚ؤ‚¢‚ـ‚¹‚ٌپB
ISO13485‚ھ‹Kگ§–ع“I‚ج‹Kٹi‚إ‚ ‚邱‚ئ‚ھ‚±‚ج‚±‚ئ‚©‚ç‚àژf‚¦‚ـ‚·پB
پ،ƒvƒچƒZƒXƒAƒvƒچپ[ƒ`
‘gگD‚جŒآپX‚جٹˆ“®پiƒvƒچƒZƒXپj‚ة‚ح‰½‚ھ‚ ‚é‚ج‚©پA‚ا‚ج‚و‚¤‚بڈ‡ڈک‚إ‚·‚·‚ك‚é‚ج‚ھ—ا‚¢‚©پA‚»‚جٹˆ“®‚ًچs‚¤‚ة‚ح‚ا‚ج‚و‚¤‚بژ‘Œ¹پiگlپAƒ‚ƒmپEپEپj‚ھ•K—v‚©پAٹˆ“®‚جŒ‹‰ت‚ح‚ا‚¤•]‰؟‚µ‚½‚èŒںڈط‚·‚é‚ج‚©پA“™پX‚ًگ®—‚µ‚½‚¤‚¦‚إپAŒّ‰ت“I‚ة‘gگDٹˆ“®‚ًچs‚¤‚±‚ئ‚ھ‚إ‚«‚é‚و‚¤‚ة‚·‚é‚ج‚ھپAƒvƒچƒZƒXƒAƒvƒچپ[ƒ`‚جٹT”O‚إ‚·پB
ISO13485‚إ‚حپAISO9001‚إ‚àچج—p‚³‚ê‚ؤ‚¢‚éƒvƒچƒZƒXƒAƒvƒچپ[ƒ`‚جٹT”O‚ًژو‚è“ü‚ê‚ؤ‚¢‚ـ‚·پB
پ،ƒٹƒXƒNƒ}ƒlƒWƒپƒ“ƒg
ƒٹƒXƒNƒ}ƒlƒWƒپƒ“ƒg‚ئ‚حپAˆم—أ‹@ٹي‚ًژg—p‚·‚邱‚ئ‚إگl‚ة‰½‚ç‚©‚جٹëٹQ‚ھ”گ¶‚µ‚ب‚¢‚©‚»‚ج‰آ”\گ«‚ً‘z’肵پAٹëٹQ‚ھ”گ¶‚·‚錹‚ًژو‚èڈœ‚‚±‚ئ‚إ‚·پBISO13485‚إ‚حپAگ»•i‚جژَ’چ‚©‚ç”[•iŒم‚ةژٹ‚é‘S‚ؤ‚ج’iٹK‚إژہژ{‚·‚邱‚ئ‚ھ—v‹پ‚³‚ê‚ؤ‚¢‚ـ‚·پB
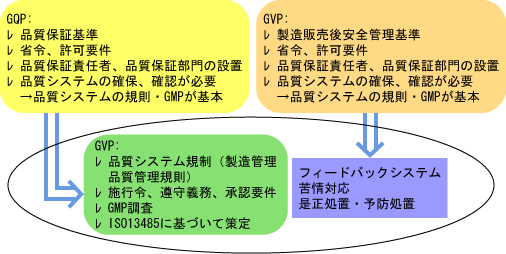
•½گ¬14”N7Œژ‚ةŒِ•z‚³‚ꕽگ¬17”N7Œژژ{چs—\’è‚ج‰üگ³–ٍژ––@‚ة‚و‚èپA‹–‰آ—vŒڈ‚ئ‚µ‚ؤ‚جگ»‘¢”ج”„•iژ؟•غڈطٹîڈ€پiGQPپjپAگ»‘¢”ج”„Œمˆہ‘Sٹا—ٹîڈ€پiGVPپj‚ض‚ج‘خ‰‚ھپAˆم—أ‹@ٹيگ»‘¢”ج”„ٹé‹ئپAˆم—أ‹@ٹي—A“ü”ج”„ٹé‹ئ‚ة‚¨‚¢‚ؤ•Kگ{ژ–چ€‚ئ‚ب‚è‚ـ‚·پB
‚ـ‚½پAˆم—أ‹@ٹيگ»‘¢‹ئ‚ة‚¨‚¢‚ؤ‚حپAگV‚µ‚ISO13485:2003‚ًٹî‚ة‚µ‚½گ»‘¢ٹا—‹y‚ر•iژ؟ٹا—‚جٹîڈ€پiGMPپj‚ض‚ج‘خ‰‚ھ•K—v‚ئ‚ب‚è‚ـ‚·پB
ˆم—أ‹@ٹيگ»‘¢”ج”„ٹé‹ئپAˆم—أ‹@ٹي—A“ü”ج”„ٹé‹ئ‚إ‚حپAژہژ؟“I‚ةISO13485:2003‚ة‚و‚éٹا—‚ھ•K—v‚ة‚ب‚è‚ـ‚·پB
چ‚“xٹا—ˆم—أ‹@ٹي‚ح‘هگbڈ³”F‚ھ•K—v‚إپAŒْگ¶کJ“ڈبپi“ئ—§چsگ–@گl‚ًٹـ‚قپjپA“s“¹•{Œ§‚جگRچ¸‚ھ•K—v‚إ‚·پB
ٹا—ˆم—أ‹@ٹي‚حŒْگ¶کJ“ڈب‚ھ”F’肵‚½‘وژOژز”Fڈط‹@ٹض‚جگRچ¸‚ھ•K—v‚إ‚·پB
‚±‚ê‚ç‚جگRچ¸‚إ‚حپAISO13485پF2003‚ض‚ج“Kچ‡گ«‚ج‘¼پAˆم—أ‹@ٹي‚جٹî–{—vŒڈٹîڈ€‚ض‚ج“Kچ‡گ«“™‚àگRچ¸‚³‚ê‚ـ‚·پB
پ،GMPپiگ»‘¢ٹا—‹y‚ر•iژ؟ٹا—‚ةٹض‚·‚éٹîڈ€: Good Manufacturing Practiceپj
گ»‘¢‹ئژز‚ة—v‹پ‚³‚ê‚éٹîڈ€پB‰ü’ùGMP‚حISO13485‚ةڈ€‹’‚µ‚ؤ‚¢‚邽‚كپAژ–ژہڈمپAگ»‘¢‹ئژز‚حISO13485‚ةٹî‚أ‚پA•iژ؟ƒ}ƒlƒWƒپƒ“ƒgƒVƒXƒeƒ€‚ًچ\’z‚µ‚ب‚¯‚ê‚خ‚ب‚ç‚ب‚¢‚±‚ئ‚ة‚ب‚è‚ـ‚·پBڈ]—ˆ‚جGMP‚حگ»‘¢چH’ِ‚ة‚¨‚¯‚éٹا—ٹîڈ€‚ً’†گS‚ةگ§’肵‚ؤ‚¢‚ـ‚µ‚½‚ھپA‰ü’ùGMP‚إ‚ح‘gگD‚جƒ}ƒlƒWƒپƒ“ƒg‚ةٹض‚·‚é—v‹پژ–چ€پi–ع•Wٹا—‚âپA“à•”ٹؤچ¸‚ب‚اپj‚ھٹـ‚ـ‚ê‚ؤ‚¢‚ـ‚·پB
پ،GQPپiگ»‘¢”ج”„•iژ؟•غڈطٹîڈ€: Good Quality Practiceپj
گ»‘¢”ج”„‹ئژز‚ة‹–‰آ—vŒڈ‚ئ‚µ‚ؤ—v‹پ‚³‚ê‚éٹîڈ€‚إ‚·پB•iژ؟•غڈطگس”Cژز‚جگف’uپA•iژ؟ٹا—•”–ه‚جگف’u‚ب‚ا‚ھ‹پ‚ك‚ç‚ê‚é‚ظ‚©پAگ»‘¢‹ئژز‚جGMP‚جISO13485“Kچ‡ٹm”F‚âپAگ»‘¢‹ئژز‚ج•iژ؟ٹا—‚ة‚آ‚¢‚ؤگ»‘¢‹ئژز‚ئژو‚茈‚ك‚ًچs‚¤‚±‚ئ‚ھ‹K’肳‚ê‚ؤ‚¢‚ـ‚·پB
پ،GVPپiگ»‘¢”ج”„Œمˆہ‘Sٹا—ٹîڈ€: Good Vigilance Practiceپj
گ»‘¢”ج”„‹ئژز‚ة‹–‰آ—vŒڈ‚ئ‚µ‚ؤ—v‹پ‚³‚ê‚éٹîڈ€پBƒNƒ‰ƒX•ھ—ق‚ة‚و‚è—v‹پژ–چ€‚حˆظ‚ب‚é‚à‚ج‚جپA‚·‚ׂؤ‚جگ»‘¢”ج”„‹ئژز‚ج“K—p‚³‚ê‚ـ‚·پBژs”جŒم‚جˆہ‘S‘خچô‚ئ‚µ‚ؤپAˆہ‘Sٹا—گس”Cژز‚جگف’uپAˆہ‘Sٹا—•”–ه‚جگف’u‚ب‚ا‚ھ‹پ‚ك‚ç‚ê‚é‚ظ‚©پAˆہ‘Sٹا—‚ة•K—v‚بڈî•ٌ‚جژûڈW‚ئپAˆہ‘Sٹm•غ‚·‚邽‚ك‚جژèڈ‡‚جٹm—§‚ھ‹پ‚ك‚ç‚ê‚ؤ‚¢‚ـ‚·پB

ISO‚ةٹض‚·‚邨–âچ‡‚¹پEŒ©گدˆث—ٹ‚ب‚اپA‚ا‚ٌ‚ب‚±‚ئ‚إ‚à‚¨‹CŒy‚ة‚²‘ٹ’k‚‚¾‚³‚¢پBگê–ه‚جƒXƒ^ƒbƒt‚ھ’ڑ”J‚ة‚¨‰‚¦‚µ‚ـ‚·پI




پEچ‘“à—Lگ”‚جژx‰‡ƒRƒ“ƒTƒ‹ژہگر
پEŒ»–ًگRچ¸ˆُ‚ة‚و‚é’¼گعژw“±
پE100پ“ژو“¾•غڈلپ•ژw“±•iژ؟•غڈطگ§“x
پE’تڈي‹ئ–±‚ة•‰’S‚ً‚©‚¯‚ب‚¢ژw“±
پEچ\’zƒVƒXƒeƒ€‚جƒٹپ[ƒKƒ‹ƒ`ƒFƒbƒN
پEƒRƒ“ƒvƒ‰ƒCƒAƒ“ƒXپECSR‘خچô

پ،ٹا—–{•”
پ§812-0011
•ں‰ھŒ§•ں‰ھژs”ژ‘½‹و”ژ‘½‰w‘Oژl’ڑ–ع8”ش12چ†
‘وŒـƒVƒXƒRƒ“ƒrƒ‹5ٹK
TELپF092-432-3003(‘م) FAXپF092-432-3103
پ،“Œ‹‰c‹ئڈٹ
پ§162-0825
“Œ‹“sگVڈh‹وگ_ٹyچâŒـ’ڑ–ع20”ش5چ†
پ،ژ––±ڈW’†ƒZƒ“ƒ^پ[
پ§812-0011
•ں‰ھŒ§•ں‰ھژs”ژ‘½‹و”ژ‘½‰w‘Oژl’ڑ–ع3”ش11چ†
TELپF092-483-7111 FAXپF092-483-8383
پ،Œ¤ڈCƒZƒ“ƒ^پ[
پ§810-0014
•ں‰ھŒ§•ں‰ھژs’†‰›‹و•½”ِˆê’ڑ–ع11”ش5چ†
‘و”ھƒVƒXƒRƒ“ƒrƒ‹1ٹK
پ،Œo‰cژx‰‡ژ–‹ئ•”
پ§810-0001
•ں‰ھŒ§•ں‰ھژs’†‰›‹و“Vگ_“ٌ’ڑ–ع6”ش17چ†
ژًˆنƒrƒ‹2ٹK
TELپF092-724-7151(‘م) FAXپF092-752-1348
پ،ƒZƒ~ƒiپ[ƒ‹پ[ƒ€
پ§812-0011
•ں‰ھŒ§•ں‰ھژs”ژ‘½‹و”ژ‘½‰w‘Oژl’ڑ–ع8”ش12چ†
‘وŒـƒVƒXƒRƒ“ƒrƒ‹4ٹK